Velázquez-Delgado Perla Ivette1, Gutiérrez-Blanco Eduardo2*, Ortega-Pacheco Antonio2, Aguilar-Caballero Armando Jacinto2, Bolio-González Manuel Emilio2, Erales-Villamil José2
1 Estudiante Doctorado FMVZ-UADY.
2 Depto. Salud Animal y Medicina Preventiva. FMVZ. Universidad Autónoma de Yucatán. *Autor de correspondencia gublan@correo.uady.mx
Antecedentes
Los avances actuales sobre la neurofisiología y el manejo del dolor han permitido establecer abordajes terapéuticos más racionales, que no sólo lo prevengan o disminuyan, sino también que reduzcan las alteraciones fisiológicas que el dolor desencadena (Whizar-Lugo et al., 2013). Lo anterior es un punto clave en los sistemas de producción, por su impacto directo sobre los parámetros productivos (Galatos, 2011; Newton y O’Connor, 2013). Dichas alteraciones (metabólicas, neuroendocrinas e inmunológicas), pueden llevar a la pérdida de apetito, al catabolismo tisular e inmunosupresión (Muir, 2015; Wiese y Yaksh, 2015). Sin embargo, los profesionales dedicados a los rumiantes a menudo se enfrentan con limitaciones en la selección e implementación de una terapia farmacológica adecuada para el manejo del dolor transquirúrgico (Lin, 2014), influenciados en gran medida por el procedimiento a realizar, su experiencia, la economía, instalaciones, el personal disponible (Anderson y Edmondson, 2013; Lin, 2014; Newcomer y Walz, 2014; Valverde y Sinclair, 2015) y el interés propio del productor. Una práctica común es la combinación de técnicas de anestesia local o regional (generalmente con el uso de anestésicos locales) con métodos de restricción (físicos y/o químicos), permitiendo que muchos de los procedimientos quirúrgicos se realicen de pie e incluso bajo condiciones de campo (Lin, 2014; Valverde y Sinclair, 2015; Edmondson, 2016). Esto se ha desarrollado como una alternativa a la anestesia general y, principalmente, al riesgo asociado a su uso debido a las particularidades de su sistema digestivo (Lemke, 2004; Hodgkinson y Dawson, 2007; Edmondson, 2014; Valverde y Sinclair, 2015).
Mientras que la mayoría de los analgésicos disminuyen la cantidad de neurotransmisores excitatorios, o aumentan el nivel de neurotransmisores inhibitorios liberados en la vía nociceptiva; los anestésicos locales impiden completamente la transmisión de estímulos nocivos periféricos a la médula espinal y al cerebro, proporcionando un bloqueo completo del impulso nocioceptivo y previniendo el desarrollo del dolor (Lemke, 2004; Lerche, 2016). Esto, a su vez, disminuye la respuesta de estrés al trauma quirúrgico y al desarrollo de la sensibilización central (Muir y Hubbell, 2013), mejorando notablemente la analgesia y el bienestar de los pacientes (Lemke, 2004; Hodgkinson y Dawson, 2007; Edmondson, 2014; Valverde y Sinclair, 2015).
Abordaje del flanco abdominal
En rumiantes, la región del flanco es el sitio más común para cualquier laparotomía (cesárea, rumenotomía, obstrucción intestinal, vólvulo, hernia, etc.) (Kumar, 2003; Lee, 2006). Esta zona está delimitada cranealmente por la treceava costilla, dorsalmente por los procesos espinales de las vértebras lumbares y caudalmente por el músculo oblicuo interno abdominal (Schwarze, 1970; Mansour et al., 2018). El flanco abdominal está formado por varias capas de tejidos, tales como la piel, el conectivo subcutáneo, los músculos oblicuos (externos e internos) y el peritoneo parietal como la capa más interna (Mansour et al., 2018). Esta área es inervada por los nervios espinales de la treceava vértebra torácica (nervio costoabdominal) y por la primera (nervio iliohipogástrico), segunda (nervio ilioinguinal) y tercera lumbar (nervio genitofemoral) (Schwarze, 1970; Getty, 1975).
TÉCNICAS ANESTÉSICAS
PARA LA INSENSIBILIZACIÓN DEL FLANCO ABDOMINAL
Existen diversas técnicas de anestesia local y regional que pueden ser usadas para insensibilizar esta zona. Estas técnicas incluyen el bloqueo en línea o incisión, el bloqueo en L invertida y el bloqueo paravertebral proximal y distal (Valverde y Sinclair, 2015).
Bloqueo en línea o incisión
La infiltración del anestésico local en el lugar de la incisión o el bloqueo en línea pueden utilizarse para insensibilizar una zona seleccionada del flanco abdominal o la fosa paralumbar. Se emplea una aguja de 2.5-3.8 cm, calibre 20 G, administrándose volúmenes de 1-2 mL de lidocaína al 2 % por sitio. La cantidad de anestésico local necesario para proveer una anestesia adecuada dependerá del tamaño de la zona que se va a insensibilizar: en un paciente de 40 kg, el uso de un volumen de 10-12 mL de lidocaína al 2 % corresponde a la dosis de 5-6 mg/kg, exceder esta dosis total puede provocar signos de intoxicación, ya que la absorción desde las capas musculares es probablemente rápida. En general se considera que bajo la utilización de lidocaína al 2 %, se espera una duración del bloqueo de aproximadamente 60-90 minutos. El retraso en la cicatrización de la herida quirúrgica es una posible complicación de esta técnica (Edmonson, 2014; Valverde y Sinclair, 2015). La anestesia del flanco requiere el bloqueo sensorial de todas las capas, incluido el peritoneo, lo que hace que esta técnica sea inadecuada si la propagación del anestésico no alcanza todas las capas (Valverde y Sinclair, 2015).
El bloqueo en L invertida
Es un bloqueo regional no específico, para una correcta nomenclatura, el flanco izquierdo se bloquea por medio de la infiltración del anestésico local en forma de “L” invertida o de “7” invertido, mientras que el flanco derecho se bloquea en forma de “7”. La infiltración del anestésico local se realiza a lo largo del borde caudal de la última costilla y la cara ventral de las apófisis transversas de las vértebras lumbares, bloqueando de esta manera la transmisión del impulso nocioceptivo desde la periferia (zona del flanco) hasta la médula espinal. Requiere volúmenes similares a las técnicas de infiltración en línea. Sin embargo, este bloqueo proporciona una mayor difusión del anestésico local que el bloqueo lineal; no obstante, como se realiza en dos ejes, es importante distribuir la cantidad de anestésico local de manera uniforme para evitar un bloqueo incompleto del flanco abdominal, así como la falta de relajación de las paredes musculares. Al igual que en el bloqueo lineal, la duración de la acción es de aproximadamente 60-90 minutos (Edmonson, 2014; Valverde y Sinclair, 2015) y presenta el mismo riesgo de toxicidad por los volúmenes de anestésicos necesarios para su realización (Edmonson, 2014).
Bloqueo paravertebral
La técnica paravertebral consiste en la inyección perineural del anestésico local adyacente a los nervios espinales, a medida que estos emergen del canal vertebral (Valverde y Sinclair, 2015). Este bloqueo anestésico también se conoce como bloqueo paravertebral proximal (técnica Farquharson, Hall o Cambridge) o bloqueo paravertebral distal (técnica de Magda, Cakala o Cornell) esto en relación con el tipo de aproximación que se realiza durante el bloqueo, donde generalmente los nervios espinales T13, L1 y L2 son bloqueados. Actualmente se ha comprobado que la inclusión del nervio espinal L3 puede proporcionar una mejor anestesia del tercio caudal del flanco abdominal (Valverde y Sinclair, 2015). Al realizar este tipo de bloqueo, las ramas dorsal y ventral de cada nervio deben ser bloqueadas si se desea una anestesia completa del flanco (Valverde y Sinclair, 2015).
Esta técnica es ideal para el abordaje de flanco y preferible a las técnicas anestésicas de infiltración, debido al menor volumen de agente anestésico requerido, la generación de una anestesia más extensa de la pared abdominal y a que proporciona un bloqueo más preciso, debido a la administración del anestésico local de manera más circunscrita a los nervios principales, produciendo bloqueos con una duración mayor (90-120 min). Así mismo, reduce la presencia de hematomas y tumefacción postoperatoria (Rostami y Vesal 2011; Valverde y Sinclair, 2015). En comparación con la anestesia epidural lumbosacra, no produce depresión respiratoria, hipotermia o parálisis de las extremidades posteriores (Skarda y Tranquilli, 2015; Oliveira et al., 2016). Además de proveer el bloqueo sensorial de la zona, también se ven afectadas las fibras motoras y simpáticas, lo que provoca la relajación de los músculos epaxiales lumbares y vasodilatación, respectivamente. Por lo tanto, la columna vertebral se curva (escoliosis) hacia el sitio bloqueado y la temperatura de la piel sobre el flanco aumenta (Valverde y Sinclair, 2015). Este bloqueo se realiza habitualmente en la práctica clínica de bovinos; empero, existen pocos estudios clínicos de esta técnica en pequeños rumiantes, en los cuales se ha descrito una baja tasa de éxito del bloqueo al emplear las técnicas convencionales (proximal y distal) por extrapolación de las técnicas descritas en bovinos (Rostami y Vesal 2011; Oliveira et al., 2016; Gayas et al., 2020). Esto es debido a las variaciones anatómicas de la zona, así como en el curso de las ramas dorsales y ventrales de estos nervios, principalmente en los espinales de la primera y segunda lumbares, requiriendo dosis mayores de anestésicos locales (Roe, 1986; Oliveira et al., 2016). Esta situación es de vital importancia en el ovino, dada su susceptibilidad al desarrollo de toxicidad a los anestésicos locales (Hodgkinson y Dawson, 2007; Anderson y Edmondson, 2013). Esta toxicidad va a depender de múltiples factores entre los cuales se encuentran: la dosis, la velocidad de inyección, la administración intravascular involuntaria, el grado de absorción del sitio y la administración conjunta de otros fármacos (Valverde y Sinclair, 2015). De acuerdo con diversos autores, este bloqueo puede realizarse en pequeños rumiantes de manera más segura y eficaz con el conocimiento de la anatomía topográfica del curso de los nervios involucrados (Sikder et al., 2010; Clarke et al., 2014; Nev et al., 2017). Sin embargo, hasta el momento de la realización de este trabajo, sólo existen dos artículos que hayan descrito la anatomía topográfica de esta zona en cabras (Sikder et al., 2010; Nev et al., 2017). De la misma manera que las disciplinas quirúrgicas, es necesario tener un conocimiento práctico de la anatomía y las estructuras asociadas que no incluyan detalles innecesarios (Hadzic y Franco 2012), de tal forma que permita establecer un abordaje efectivo de esta zona.
En la literatura se han descrito diferentes volúmenes a administrar para la realización del bloqueo del nervio paravertebral en pequeños rumiantes (Cuadro 1). No obstante, estudios clínicos han concluido que estos pudieran ser insuficientes para lograr el bloqueo de los nervios espinales durante la realización, al desarrollar una anestesia incompleta del flanco. Con todo, es importante considerar que existen diversos factores además de los anatómicos (Sikder et al., 2010; Oliveira et al., 2016; Nev et al., 2017) y el volumen (Oliveira et al., 2016; Gayas et al., 2020), que pudieran influir en la tasa de éxito de un bloqueo, como la forma de administración (dosis única o de forma continua) (Luyet et al., 2011), cantidad de inyecciones siendo de forma única (Naja et al., 2004) o múltiples (Uppal et al., 2018) y la técnica de localización empleada (Rioja et al., 2012).
Consideraciones finales
Es importante considerar la falta de información sobre la realización de este bloqueo enfocado en pequeños rumiantes, tomando en cuenta la importancia clínica de los abordajes quirúrgicos por el flanco. No se debe seguir considerando a los pequeños rumiantes como bovinos pequeños, ya que sus diferencias anatómicas han sido demostradas anatómica y clínicamente.
Conclusiones
La anestesia loco-regional en pequeños rumiantes y específicamente en ovinos, debe ser re-evaluada anatómica y clínicamente para poder ser realizada con éxito y con menos probabilidad de intoxicación del sistema nervioso central. Son necesarios estudios que evalúen la pertinencia del uso de adyuvantes que permitan disminuir la dosis de anestésicos locales en ovinos.
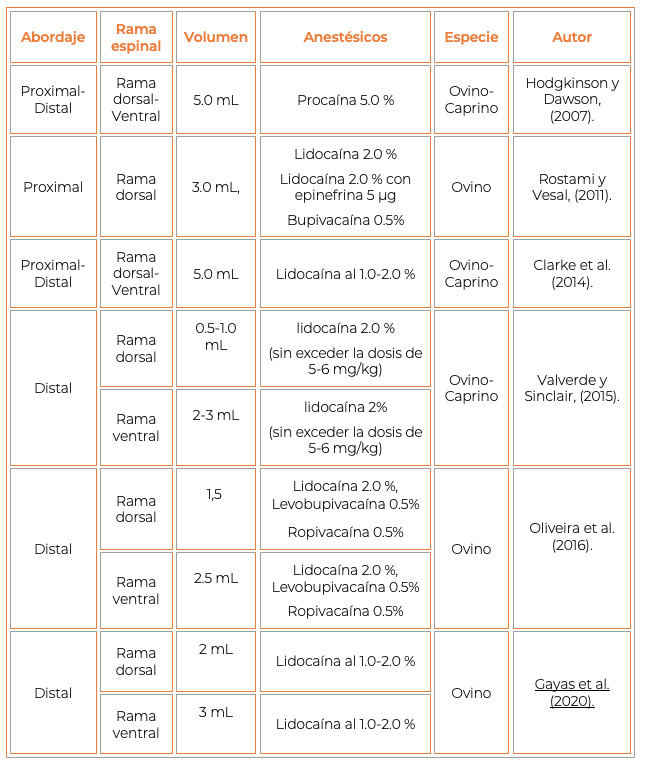
Cuadro 1. Anestésicos locales y volúmenes recomendados para la anestesia paravertebral en pequeños rumiantes.
REFERENCIAS
Anderson, D.E., Edmondson, M.A. (2013). Prevention and Management of Surgical Pain in Cattle. Veterinary Clinics of North America: Food Animal Practice, 29,157–184. https://doi.org/10.1016/j.cvfa.2012.11.006
Clarke, K.W., Trim, C.M., Hall, L.W. (2014). Anaesthesia of cattle. En: Clarke, K.W., Trim, C.M., Hall, L.W. Veterinary Anaesthesia (Eds.). Eleventh Edition. W.B., Saunders, pp. 313-343.
Edmondson, M. (2013). Local and regional anesthetic Techniques. En: Lin, H, Walz, P (eds.). Farm Animal Anesthesia: Cattle, Small Ruminants, Camelids, and Pigs. John Wiley & Sons, Inc, Chichester, UK, pp. 174-214.
Edmondson, M.A. (2014). Local and regional anesthetic techniques. En: Lin, H., Walz, P. (eds.). Farm Animal Anesthesia: Cattle, Small Ruminants, Camelids, and Pigs. John Wiley & Sons, Inc, Chichester, UK, pp. 136-154.
Edmondson, M.A. (2016). Local, Regional, and Spinal Anesthesia in Ruminants. Veterinary Clinics of North America – Food Animal Practice, 32(3), 535–552. https://doi.org/10.1016/j.cvfa.2016.05.015
Galatos, A.D. (2011). Anesthesia and Analgesia in Sheep and Goats. Veterinary Clinics of North America – Food Animal Practice, 27(1), 47–59. https://doi.org/10.1016/j.cvfa.2010.10.007
Gayas, M. A., Fazili, M. ur R., Aijaz, R., Handoo, N., Gugjoo, M. B., Dar, S. H., & Teeli, A. S. (2020). Distal paravertebral nerve block in sheep undergoing laparohysterotomy: comparing the use of 1 % and 2 % lignocaine hydrochloride. Small Ruminant Research, 192, 106185. https://doi.org/10.1016/j.smallrumres.2020.106185
Getty, R. (1975). Spinal Nerves. En: The Anatomy of the Domestic Animals, Volume 1. Fifth Edition. WB Saunders Philadelphia, USA, pp 1135-1141.
Hadzic, A., Franco, C. (2012). Essential Regional Anesthesia Anatomy. In: Hadzic’s Peripheral Nerve Blocks and Anatomy for Ultrasound Guided Regional Anaesthesia (2nd edn). Hadzic A (ed.). McGraw Hill Medical, NY, USA, pp. 24-83.
Hodgkinson, O., Dawson, L. (2007). Practical anaesthesia and analgesia in sheep, goats and calves. In Practice, 29(10), 596–603. https://doi.org/10.1136/inpract.29.10.596
Kumar, A. (2003). Paravertebral Anaesthesia. En: Veterinary Surgical Techniques. 1st Ed., Vikas Publishing House PVT. LTD., New Delhi,India, pp. 117-119.
Lee, L. (2006). Local Anaesthesia & Analgesia. En: Veterinary Surgery. Pp. 12-18.
Lemke, K.A. (2004). Understanding the pathophysiology of perioperative pain. Canadian Veterinary Journal, 45,405-413.
Lerche, P. (2016). Introduction. En: Lerche, P., Aarnes, T., Covey-Crump, G., Martinez Taboada, F. Handbook of Small Animal Regional Anesthesia and Analgesia. Wiley-Blackwell, pp. 1-12.
Lin, H. 2014. Preanesthetic considerations. En: Lin, H., Walz, P. (eds.). Farm Animal Anesthesia: Cattle, Small Ruminants, Camelids, and Pigs. John Wiley & Sons, Inc, Chichester, UK, pp. 1-18.
Luyet, C., Herrmann, G., Ross, S., Vogt, A., Greif, R., Moriggl, B., Eichenberger, U. (2011). Ultrasound-guided thoracic paravertebral puncture and placement of catheters in human cadavers: where do catheters go? All experiments were performed at the Institute of Anatomy of the University of Bern, Bern, Switzerland. British Journal of Anaesthesia, 106(2), 246–254. https://doi.org/10.1093/bja/aeq309
Mansour, M., Wilhite, R., Rowe, J. (2018). Guide to Ruminant Anatomy: Dissection and Clinical Aspects. First Edition. John Wiley & Sons, Inc. pp. 92-96.
Muir, W.W. (2015). Pain and Stress Stress-Induced Hyperalgesia and Hypoalgesia. En: Gaynor, J.S., Muir, W.W. (eds.). Handbook of Veterinary Pain Management. 3th Edition. Elsevier Inc. USA, pp. 43-60.
Muir, W.W., Hubbell, J.A.E. (2013). Handbook of Veterinary Anesthesia, 5th Edition. Elsevier Mosby, St. Louis, MO, USA.
Naja, M. Z., Ziade, M. F., Rajab, M. E., Tayara, K. E., Lönnqvist, P. A. (2004).
Varying anatomical injection points within the thoracic paravertebral space: effect on spread of solution and nerve blockade. Anaesthesia, 59(5), 459–463. https://doi.org/10.1111/j.1365-2044.2004.03705.x
Nev, T.O., Banet, O., Elsa, T.A. (2017). Investigation of anatomical landmarks for paravertebral anaesthesia in West African Dwarf goats (Capra hircus). Sokoto Journal of Veterinary Sciences, 15, 88-93. https://doi.org/10.4314/sokjvs.v15i4.13
Newcomer, B., Walz, P. (2014). Anesthetic management for specific procedures. En: Lin, H., Walz, P. (eds.). Farm Animal Anesthesia: Cattle, Small Ruminants, Camelids, and Pigs. John Wiley & Sons, Inc, Chichester. UK, pp. 155.
Newton H.P., O’Connor A.M. (2013). The economics of pain management. Veterinary Clinics Food Animal, 29:229-250. https://doi.org/10.1016/j.cvfa.2012.11.010
Oliveira, A. R., Araújo, M. A., Jardim, P. H., Lima, S. C., Leal, P. V., Frazílio, F. O. (2016). Comparison of lidocaine, levobupivacaine or ropivacaine for distal paravertebral thoracolumbar anesthesia in ewes. Veterinary Anaesthesia and Analgesia, 43(6), 670–674. https://doi.org/10.1111/vaa.12353
Rioja, E., Sinclair, M., Chalmers, H., Foster, R. A., Monteith, G. (2012). Comparison of three techniques for paravertebral brachial plexus blockade in dogs. Veterinary Anaesthesia and Analgesia, 39(2), 190–200. https://doi.org/10.1111/j.1467-2995.2011.00677.x
Roe, J.M. 1986. Bovine Paravertebral Analgesia: radiographic analysis and suggested method for improvement. Veterinary Records, 119(10), 236-238.
Rostami, M., Vesal, N. (2011). Comparison of lidocaine, lidocaine/epinephrine or bupivacaine for thoracolumbar paravertebral anaesthesia in fat-tailed sheep. Veterinary Anaesthesia and Analgesia, 38, 598–602. https://doi.org/10.1111/j.1467-2995.2011.00658.x.
Schwarze, E. (1970). Sistema Nervioso Órganos de los Sentidos. En: Schwarze, E., Schröder, L. Compendio de Anatomía Veterinaria. Editorial Acribia. Zaragoza, España, pp. 61-66, 78-80.
Sikder, S., Ahmed, S., Kibria, A., Pallab, M., Uddin, M., Basu, J., Uddin, M. (2010). Anatomical measurements for the blocking sites of paravertebral regional anaesthesia in Black Bengal Doe. Bangladesh Journal of Veterinary Medicine, 8(1), 81–86. https://doi.org/10.3329/bjvm.v8i1.8354
Skarda, R.T., Tranquilli, W.J. (2015). Local Anesthetics. En: Tranquilli, W.J., Thurmon, J.C. y Grimm, K.A. (Eds), Lumb and Jones’ Veterinary Anesthesia and Analgesia. The Fifth Edition. Blackwell Publishing, Iowa, EUA, pp. 395-418.
Uppal V, Sondekoppam RV, Sodhi P, Johnston D, Ganapathy S. (2017). Single-Injection Versus Multiple-Injection Technique of Ultrasound-Guided Paravertebral Blocks: A Randomized Controlled Study Comparing Dermatomal Spread. Reg Anesth Pain Med, 42(5), 575-581. https://doi.org/10.1097/AAP.0000000000000631
Valverde, A., Sinclair, M. 2015. Ruminant and Swine Local Anesthetic and Analgesic Techniques. En: Tranquilli, W.J., Thurmon, J.C., Grimm, K.A. (Eds), Lumb and Jones’ Veterinary Anesthesia and Analgesia. The Fifth Edition. Blackwell Publishing, Iowa, EUA, pp. 941-958.
Whizar-Lugo, V.M., Granados, M., De Lille, R., Gómez-Gutiérrez, C., Zepeda-Mendoza, A.D. (2013) Alternativas de analgesia: interacciones entre fármacos y receptores. Actas Peruanas de Anestesiol, 21, 27-42.
Wiese, A.J., Yaksh, T.L. (2015). Nociception and pain mechanisms. En: Gaynor, J.S., Muir, W.W. (eds.). Handbook of Veterinary Pain Management. 3th Edition. Elsevier Inc. USA.