*1Melissa Sagrero-Del Moral y 2Julio César Castañeda-Ortega.
1Médico Veterinario Zootecnista; 2Biólogo, Maestría y Doctorado en Neuroetología. Facultad de Medicina Veterinaria y Zootecnia – Xalapa, Universidad Popular Autónoma de Veracruz, C. P. 91100 Calle Juan Escutia No. 2 Colonia Revolución, Xalapa, Veracruz, México. *Correo electrónico: melsennheizer@gmail.com
Resumen
Con el objetivo de determinar si existen diferencias en la condición corporal entre hembras y machos, de mayo a octubre de 2019 fueron evaluados en su Condición Corporal 107 gatos adultos (66 hembras y 41 machos) se realizaron mediciones morfométricas. De las variables: circunferencia de la cabeza, circunferencia torácica, longitud del miembro torácico izquierdo, circunferencia del miembro anterior izquierdo, longitud del miembro posterior izquierdo, circunferencia del miembro posterior izquierdo y la longitud corporal, se encontró que los machos fueron significativamente mayores en las variables peso (p = 0.001), circunferencia de la cabeza (p = 0.001), circunferencia torácica (p = 0.003), circunferencia de miembro torácico (p = 0.001), circunferencia de miembro pélvico (p = 0.001) y longitud corporal (p = 0.001), no así en la longitud de miembro torácico izquierdo (p = 0.435), ni en la longitud de miembro pélvico izquierdo (p = 0.165), por lo que se concluye que los machos son significativamente más grandes que las hembras.
Palabras clave
Condición corporal, dimorfismo sexual, gato doméstico, morfometría.
Introducción
El dimorfismo sexual de tamaño es un fenómeno poco comprendido respecto a sus causas citogenéticas y evolutivas (Krebs & Davies, 1993). El dimorfismo sexual puede manifestarse de diferentes maneras, mismas que han sido incluidas en cinco categorías principales: dimorfismo de tamaño, de forma corporal, de forma y tamaño de los apéndices, de características tegumentarias y de coloración e incluso las diferencias sexuales de comportamiento (Fairbairn, 1997). De todas estas categorías, el dimorfismo sexual de tamaño ha sido objeto de diversos estudios científicos que han intentado revelar sus causas próximas y últimas, aunque en muchos aspectos el problema se mantiene como un enigma biológico (Fairbairn, 2007; Rensch, 1950).
En los mamíferos y aves, los machos suelen ser físicamente mayores que las hembras, aunque un buen número de excepciones sucede en ambas clases (Lindenfors et al., 2007). A partir de la publicación de “The Descent of Man and Selection in Relation to Sex” por Darwin (1871), el dimorfismo sexual ha sido considerado esencialmente como producto de la acción de la selección sexual en el sentido darwiniano de competición intrasexual por el acceso a la pareja en uno de los sexos, y la elección o preferencia por parte del otro (Dale et al., 2007; Isaac 2005; Andersson, 1994), sin embargo, la selección natural clásica también puede explicar el dimorfismo sexual de tamaño si favoreciese diferentes tamaños corporales para adecuar los sexos a diferentes papeles ecológicos o de utilización de nicho, o si la competencia alimentaria ocurre entre machos y hembras (Isaac, 2005; Mysterud, 2000). Es importante destacar que la divergencia de nicho o segregación sexual entre hembras y machos probablemente no sea independiente de la diferenciación que ambos sexos experimentan en sus papeles reproductivos y en muchos casos, es muy difícil separar los efectos de uno u otro tipo de selección (Fairbairn, 2007; Hedrick & Temeles, 1989).
Según Rensch, (1960) la variación del tamaño del cuerpo entre especies relacionadas, a menudo sigue patrones evolutivos que son notablemente consistentes en los taxones, la regla de Rensch (1950) propone que la cantidad de dimorfismo sexual de tamaño tiende a aumentar con el incremen-
to del tamaño de los machos y decrece si las hembras son mayores (Bidau & Martí, 2008; Fairbairn, 2007; Abouheif & Fairbairn, 1997). Esta tendencia evolutiva se presenta en los grandes felinos, existiendo una fuerte covariación de la talla entre sexos marcando un fuerte dimorfismo entre estos (Lindenfors et al., 2007), siendo los machos más grandes que las hembras (Martínez et al., 2014) por ende y debido a su cercanía filogenética, se plantea la duda si los gatos domésticos presentarán este dimorfismo sexual en la talla.
La morfometría tiene características relacionadas con la naturaleza de los datos primarios y así como la capacidad de aplicarse a estudios multivariados, lo que la hace una herramienta muy útil en el análisis de las variaciones de la forma, además gracias a sus continuos avances, es altamente utilizada en los estudios de las ciencias morfológicas, por lo que su conocimiento no sólo es importante para introducir una nueva técnica de análisis (Zavando et al., 2009). Mediante esta herramienta podemos conocer las variaciones morfológicas de los organismos y cómo afecta a sus poblaciones, lo que nos permite contrastar las estructuras que presentan estas divergencias, en el orden que sean medibles y o cuantificables, identificando los caracteres asociados con diferentes aspectos generales de los individuos, especies o poblaciones, como hábitos, uso de hábitat, fisiología e incluso comportamiento reproductivo (Pérez & Alegría, 2009), por lo cual debe ser parte del conocimiento general fundamental en la formación y actualización de un profesional del estudio de la fauna. El objetivo de este trabajo fue determinar si existen diferencias morfométricas relevantes entre hembras y machos en una muestra de gatos de la ciudad de Xalapa, Veracruz.
Materiales y métodos
Determinación del Tamaño Óptimo de Muestra
Para conocer el número de organismos que era necesario medir para que nuestro trabajo fuera lo suficientemente robusto en términos estadísticos, se efectuó la medición de cuatro ejemplares adultos. Una vez calculado el valor de la varianza obtenida se calculó el tamaño óptimo de muestra para una confianza del 95 %, obteniendo así el resultado n = 60 gatos (Zar, 2010). Sin embargo, durante nuestra investigación se cuantificaron los datos de 107 gatos domésticos. La fórmula para calcular el tamaño óptimo de muestra fue la siguiente:
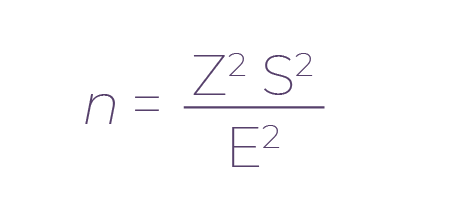
Donde n es tamaño óptimo de muestra, Z es el valor para una confianza del 95 %, S2 es la varianza estimada de la población conocida o estimada a partir de anteriores estudios o de una prueba piloto y E es el error de estimación para el valor parámetro (Tomado de Zar, 2010).
Mediciones morfométricas
Durante el período que abarcan los meses de mayo a octubre de 2019 se realizaron visitas a distintos albergues de gatos, además de las campañas de esterilización del municipio de Xalapa a cargo del MVZ Pablo Melo Flores, para realizar las mediciones morfométricas. Las variables morfométricas (Figura 1) tomadas fueron: peso, circunferencia de la cabeza, circunferencia torácica, longitud del miembro torácico izquierdo, circunferencia del miembro torácico izquierdo, longitud del miembro pélvico izquierdo, circunferencia del miembro pélvico izquierdo y la longitud corporal. Para medir y pesar a los animales se utilizó una cinta métrica graduada en centímetros marca Costur y una balanza electrónica modelo TY-2003B marca Toye.
Figura 1. Distribución de medidas morfométricas (Tomado de: Thatcher, et al., 2000).
Análisis estadístico
Para la comparación estadística de los datos morfométricos obtenidos entre machos y hembras, se utilizó la prueba no paramétrica U Mann Whitney (Martínez, 2013). Los análisis estadísticos se realizaron con el software Sigmastat 4.0 Advisory Statistics for Scientist desarrollado por Jandel Scientific Software.
Resultado
Se midieron 107 gatos adultos de los cuales 66 fueron hembras y 41 fueron machos, los resultados de las mediciones morfométricas y las comparaciones entre hembras y machos fueron los siguientes.
Peso: los machos promediaron 3.5 kg (DS = ± 0.98 kg) y las hembras pesaron en promedio 3.1 kg (DS = ± 0.84 kg) encontrándose diferencias significativas (U= 857; n1= 66; n2: 42; p: 0.001).
Circunferencia de la cabeza: los machos fueron más grandes que las hembras, en promedio los primeros midieron 24.1 cm (DS = ± 2.1 cm) y las hembras 22.1 cm (DS = ± 1.7 cm) encontrándose diferencias significativas (U: 619; n1= 44; n2: 66; p: 0.001).
Circunferencia torácica: el promedio de los machos fue de 35.7 cm (DS = ± 5.1 cm) y por 32.7 cm (DS = ± 4.9 cm) de las hembras, encontrándose diferencias significativas (U = 890; n1= 41; n2: 66; p: 0.003).
Longitud del miembro torácico izquierdo: al medir la longitud del miembro torácico, el de los machos fue más grande 22.1 cm en promedio (DS = ± 2.6 cm) por 21.3 cm de las hembras (DS = ± 2.3 cm), no obstante, no existieron diferencias significativas (U: 1037.5 n1= 41; n2: 66; p: 0.435).
Circunferencia del miembro torácico Izquierdo: en los machos en promedio fue de 8.3 cm (DS = ± 1.0 cm) por 7.4 cm (DS = ± 0.9 cm) de las hembras, arrojando diferencias significativas (U= 602.5 n1= 41; n2: 66; p: 0.001).
Longitud del miembro pélvico izquierdo: al comparar la longitud del miembro pélvico los machos en promedio midieron 22 cm (DS = ± 2.7 cm) y las hembras 21.3 cm (DS = ± 3.1 cm) sin existir diferencias significativas (U: 1136 n1= 41; n2: 66; p: 0.165).
Circunferencia del miembro pélvico izquierdo: la comparación de la circunferencia de miembro pélvico mostró que los machos midieron en promedio 7.5 cm (DS = ± 1.0 cm) por 7.0 cm de las hembras (DS = ± 1.1 cm) encontrando divergencias significativas (U= 851.0 n1= 41; n2: 66; p: 0.001).
Longitud corporal: al analizar la longitud corporal en promedio, los machos midieron 56 cm (DS = ± 4.1 cm) y las hembras 52 cm (DS =± 4.2 cm) encontrándose diferencias significativas (U= 755 n1= 41; n2: 66; p: 0.001).
Discusión
El dimorfismo sexual de tamaño es un fenómeno complejo y poco comprendido en cuanto a sus causas citogenéticas y evolutivas. En este trabajo se llevaron a cabo los estudios comparativos de estas diferencias de tamaño, con el uso de variables morfométricas en una población de gatos domésticos, que, debido a su homogeneidad morfológica, sus características reproductivas y rango de tamaño, nos arrojaron datos estadísticamente significativos.
La variación del tamaño del cuerpo entre especies relacionadas a menudo sigue patrones evolutivos que son notablemente consistentes en los taxones. Según la regla de Rensch, el dimorfismo sexual de tamaño tiende a aumentar con el tamaño del cuerpo cuando los machos son más grandes, pero disminuye cuando las hembras son de mayor tamaño (Abouheif, & Fairbairn, 1997; Rensch, 1950). Por el contrario, si las presiones de selección en las hembras son el principal impulsor de la evolución del dimorfismo sexual de tamaño, entonces ésta misma debería aumentar con el tamaño corporal promedio en la especie, pero con el sesgo hacia las hembras, lo contrario de la regla de Rensch (Webb & Freckleton, 2007).
Al comparar en este estudio a hembras con los machos, se pudo constatar que los machos son significativamente más grandes que las hembras en casi todas las variables consideradas, esto comprueba que este dimorfismo se encuentra sesgado hacia los machos, ya que, en mamíferos, los machos son usualmente mayores que las hembras con excepciones a esta regla en diferentes especies (Lindenfors et al., 2007).
Este fenómeno se puede explicar mediante el modelo de la selección natural clásica, este dimorfismo favorece diferentes tamaños corporales para adecuar los sexos a diferentes papeles ecológicos o al nicho competencia alimentaria
ocurrente entre machos y hembras (Isaac, 2005). Según Lindenfors y colaboradores (2007) los mamíferos machos son usualmente más grandes que las hembras como producto de la acción de proceso de la selección sexual, en el sentido darwiniano de competición intrasexual, lo que representa una ventaja para favorecer el acceso a las hembras, dando pie a la reproducción y conservación de la especie.
Los machos fueron más pesados que las hembras, lo que concuerda con lo reportado por Thatcher et al. (2000), el cual menciona que el aumento de peso es más común en machos, especialmente en los castrados y esto se debe a que, aunque las hormonas sexuales no son de requerimiento primario para la regulación del metabolismo, estas influyen en la alimentación y en el peso corporal directamente actuando en el Sistema Nervioso Central e indirectamente alterando el metabolismo celular, mientras que los estrógenos ejercen un efecto inhibitorio en el consumo de alimento. Sin embargo, en las hembras, el consumo de alimento varía con su ciclo estral, minimizándose durante el ciclo e incrementando durante la ausencia del mismo. Estudios recientes han demostrado que los estrógenos inhiben la lipogénesis y es un factor determinante para el número de adipocitos sobre todo en machos, la edad del gato en el momento de ser esterilizado no tiene ningún efecto sobre el desarrollo de obesidad (Diez, 2006). Durante el muestreo de esta investigación, al entrevistar a los propietarios de los ejemplares, un factor en común que tenían los machos “más grandes” era el tipo de alimentación, muchos de ellos eran alimentados con comida casera y con comida comercial al mismo tiempo en un sistema Ad libitum (libre acceso). Este tipo de alimentación -en conjunto con la esterilización-, son factores que favorecen el aumento de grasa en machos.
Conclusiones
Después de llevar a cabo la investigación correspondiente, se pudo constatar que el uso de la morfometría fue de gran apoyo, para cuantificar las características morfológicas de los organismos permitiendo el análisis estadístico para comparar ambas poblaciones de gatos hembras contra machos y así poder demostrar estadísticamente las diferencias entre ellos con respecto a sus diferentes variables, encontrando que si existen diferencias morfométricamente relevantes entre hembras y machos.
REFERENCIAS
- Abouheif, E. & Fairbairn, D. J. 1997. A comparative analysis of sexual size dimorphism: assessing Rensch’s rule. The American Naturalist 149: 540-562.
- Andersson, M. 1994. Sexual Selection. Princeton University Press, Princeton, Estados Unidos.
- Bidau, C. J., Martí, D. A. 2008. Rensch’s rule in Dichropluspratensis, a replyto Wolak. Annals of the Entomological Society of America 101: 802-803.
- Dale, J. Dunn, P. O., Figuerola, J., Lislevand, T., Székely, T., Wittingham. L. A. 2007. Sexual selection explains Rensch’s rule of Allometry for sexual size dimorphism. Proceedings of the Royal Society of London B 274: 2971–2979.
- Diez, M. 2006. The epidemiology of canine and feline obesity, IVIS, Vol. 16, No 1.
- Fairbairn, D. J. 1997. Allometry for sexual size dimorphism: pattern and process in the coevolution of body size in males and females. Annual review of ecology and systematics 28: 659-687.
- Fairbairn, D. J. 2007. Introduction: the enigma of sexual size dimorphism. En: Fairbairn. D. J., Blanckenhorn, W.U., Székely, T. (eds.), Sex, Size. Pp. 1-12. Oxfor University Press, Oxford, United Kingdom.
- Hedrick, A. V., Temeles, E.J. 1989. The evolution of sexual dimorphism in animals: hypotheses and tests. Trends in Ecology and Evolution 4: 136-138.
- Isaac, J. L. 2005. Potential causes and life-history consequences of sexual size dimorphism in mammals. Mammal Review 35: 101–115.
- Krebs, J. R. & Davies. N. 1993. An Introduction to Behavioral Ecology. Blackwell, Oxford.
- Lindenfors, P., Gittleman, J. L., Jones, K. E. 2007. Sexual size dimorphism in mammals. En: Fairbairn, D.J., Blanckenhorn, W.U., Székely, T. (eds.), Sex, Size and Gender Roles. Evolutionary Studies of Sexual Size Dimorphism, pp. 16-26. Oxford University Press, Oxford, Reino Unido.
- Martínez, E. 2013. “Métodos no paramétricos I” 2do. Cuat. Página 81. https://www.dm.uba.ar/materias/optativas/metodos_no_parametricos_1/2013/2/NoparI08.pdf
- Martínez, P. A., Ferreira A., Bidau, T. 2014. Una aproximación filogenética al studio del dimorfismo sexual de tamaño en Felidae y la evaluación de la regla de Rensch. Ecosistemas 23(1): 27-36.
- Mysterud, A. 2000. The relationship between ecological segregation and sexual body size dimorphism in large herbivores. Oecología 124: 40-54.
- Pérez, J. V., Alegría J. 2009 Evaluación morfométrica y dimorfismo sexual intra-poblacional de Rhinoclemmys nasuta (Boulenger, 1902) en una zona insular continental del Pacífico colombiano. Revista colombiana de ciencia animal 1(2): 143-156.
- Rensch, B. 1950. Die Abhangigkeit der Relativen Sexual differenz von der Korpengrösse. Bonner Zoologische Beiträge 1: 58-69.
- Rensch, B. 1960. Evolution above the Species Level. Columbia University Press, New York, Estados Unidos.
- Thatcher C. D., Hand M. S., Remillard R. L. 2000. Nutrición clínica en pequeños animales: un proceso repetitivo. Animales. Pp 1-22. Intermédica, S. A. I. C. I. Buenos Aires.
- Webb, T. J., Freckleton, R. P. 2007. Only half right: species with female-biased sexual size dimorphism consistently break Rensch’s rule. PLoS.
- Zavando, M. D. A.; Suazo, G. I. C., Smith, R. L. 2009. Determinación del dimorfismo sexual en las dimensiones lineales de cráneos. International Journal of Morphology, 27 (1): 133-7.
- Zar, J. H. 2010. Biostatistical Analysis (5ª edition). Prentice Hall.