1pMVZ Brenda Escorza Castro,
2MVZ EMCPyG MMVZ Gerardo Alberto Hernández Alberto.
1 Facultad de Estudios Superiores Cuautitlán, UNAM. brenn.deqoo@gmail.com
2 Facultad de Medicina Veterinaria y Zootenia, UNAM. healge1203@gmail.com
Resumen
La sarcopenia es similar a la caquexia, pues se caracteriza por pérdida de masa muscular, pero es un síndrome que se observa durante el envejecimiento en la ausencia de enfermedad. El propósito de esta revisión es identificar y diferenciar estos síndromes en perros y gatos; así como conocer su origen y estadificación.
PALABRAS CLAVE
Caquexia, fuerza muscular, masa corporal, masa muscular, sarcopenia.
SARCOPENIA
Desde 1989, por Irwin Rosenberg, se ha utilizado el término sarcopenia para definir a la pérdida de la masa muscular esquelética y la fuerza asociada con el envejecimiento1 específicamente en la ausencia de enfermedad1,2; el término se deriva de las palabras griegas sarx (carne) y penia (pobreza)3.
Puesto que la sarcopenia es prevalente en poblaciones mayores, se puede considerar que es un síndrome geriátrico, siendo este el resultado de interacciones incompletas de enfermedad y edad en múltiples sistemas, produciendo síntomas progresivos y pérdida generalizada de masa y fuerza del músculo esquelético con un riesgo de resultados adversos como discapacidad física, mala calidad de vida, muerte,1 anorexia y varias anomalías hematológicas y bioquímicas (por ejemplo, anemia e hipoalbuminemia).2
Se basa principalmente en la composición corporal.3
La sarcopenia puede pasar desapercibida fácilmente porque a menudo es un proceso gradual y puede enmascararse con un aumento simultáneo de la grasa corporal.4
Mecanismos
Además de la atrofia, los cambios histológicos más importantes incluyen anomalías mitocondriales y la presencia de lipofuscinas dentro de las fibras musculares, debido al daño inducido por especies reactivas de oxígeno (ROS).5
-Los mecanismos involucrados en la aparición y progresión de la sarcopenia son: síntesis de proteínas, proteólisis, integridad neuromuscular, contenido de grasa muscular1, disminución de la masa muscular, infiltración del músculo por grasa y tejido conectivo, disminución del tamaño y número de fibras tipo 2, pero también de fibras tipo 1, fibras irregulares, desorden de miofilamentos, proliferación del retículo sarcoplásmico y del sistema t-tubular, acumulación nemalina y disminución del número de unidades motoras.3 Incremento de la duración de la contracción fibrilar, cambios estructurales en las cadenas de miosina6.
La sarcopenia está influenciada por inactividad física2,3,7 y aumento de la producción de citocinas ( ej., factor de necrosis tumoral (TNF), interleucina (IL)-6, IL-1), disminución de la síntesis de proteínas y reducción en las concentraciones hormonales3,5,6,7, las más importantes son las hormonas anabólicas (testosterona, estrógenos, hormona del crecimiento, factor de crecimiento similar a la insulina-1), aumentos de las actividades apoptóticas en las miofibras, estrés oxidativo por acumulación de radicales libres, cambios en la función mitocondrial de las células musculares y disminución del número de motoneuronas а3,8. La Sarcopenia puede acelerarse después de un estrés inflamatorio agudo.3
Una de las consecuencias del estrés oxidativo que se produce en el proceso del envejecimiento es la acumulación de mutaciones a nivel del ADN mitocondrial muscular que se traduce en una reducción de la síntesis proteica, la de ATP, y finalmente provoca la muerte de la fibra muscular. No obstante, parece que su causa principal es más la baja actividad física que el propio avance de la edad.6
El acúmulo progresivo de mutaciones a nivel del ADN mitocondrial se asocia a una aceleración de la apoptosis de los miocitos que conlleva una pérdida de masa muscular, en especial de las fibras tipo II.6
Los cambios celulares subyacentes involucran debilitamiento de los factores que promueven el anabolismo muscular y aumento de la expresión de factores inflamatorios y otros agentes que contribuyen al catabolismo del músculo esquelético.8
La sarcopenia reumatoide todavía está poco estudiada; funcionalmente, los pacientes con AR (artritis reumatoide) muestran una reducción significativa de la fuerza muscular, pero la velocidad y las propiedades contráctiles del músculo permanecen inalteradas. Estos datos demuestran que el impacto de la enfermedad se produce por la pérdida de proteínas, afectando principalmente a los sarcómeros en paralelo y preservando el número de sarcómeros en serie.10
Origen y estadificación
El origen de la sarcopenia se considera primario cuando no hay evidencia de otra causa además del envejecimiento y secundario cuando se presenta alguna otra alteración relacionada.1
– Fragilidad: tres o más de las siguientes características apoyan este diagnóstico: pérdida de peso no intencionada, agotamiento, debilidad, marcha lenta y poca actividad física. El concepto general de fragilidad incluye el estado cognitivo1,11.
– Obesidad sarcopénica: esta condición se da cuando existe una pérdida de músculo y provoca la infiltración de grasa, lo cual reduce la calidad del músculo y el desempeño laboral1, se da en una condición de resistencia a la insulina, inactividad física y sobrealimentación.3
En algunas personas el origen puede ser multifactorial, por lo que es difícil clasificar en primario o secundario y sería considerado como síndrome geriátrico multifacético.1
La European Working Group on Sarcopenia in Older People (EWGSOP) sugiere la estadificación conceptual, evaluando la masa muscular, fuerza muscular y desempeño físico:
– Presarcopenia: se caracteriza por baja masa muscular sin impacto en la fuerza muscular o desempeño físico.1
– Sarcopenia: se caracteriza por una masa muscular baja, además de una fuerza muscular baja o un rendimiento físico bajo.1
– Sarcopenia grave: es la etapa identificada cuando se cumplen los tres criterios de la definición (masa muscular baja, fuerza muscular baja y rendimiento físico bajo).1
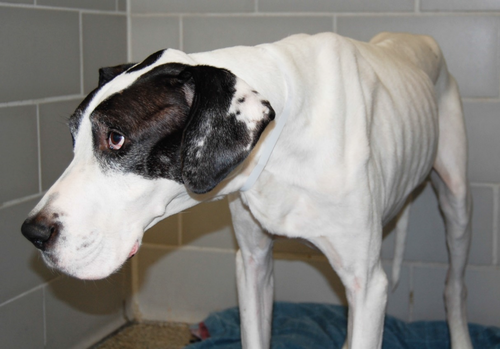
La evaluación de la pérdida muscular requiere un examen visual y palpación de la musculatura de la columna vertebral, la escápula, el cráneo y las alas del ílio4,5,7, se recomienda calificar la condición muscular como normal o con grado variable de atrofia (es decir: leve, moderada, severa).5
Las técnicas complementarias para estimar la masa muscular o la masa corporal magra son: tomografía computarizada (TC), resonancia magnética (RM) y absorciometría de rayos X de energía dual (DXA)1,5,6, determinación de agua corporal total.4
El EWGSOP ha desarrollado un algoritmo sugerido basado en la medición de la velocidad; un punto de corte de > 0,8 m/s identifica riesgo de sarcopenia.1
Se ha analizado la respuesta muscular al ejercicio una vez que la sarcopenia se ha presentado en humanos de edad avanzada y se ha demostrado que no acumulan proteínas musculares tan eficientemente como lo hacen los individuos más jóvenes.4
La sarcopenia se relaciona con una dependencia funcional, lo cual se ve reflejado por un lado en una mayor dificultad para la movilidad, expresado en una menor actividad física y mayores ayudas para la deambulación, y por otro lado en una mayor dependencia para las actividades básicas de la vida diaria11.
Se realizó un estudio en donde se comparó la condición corporal y la condición muscular en caninos Labrador Retriever entre jóvenes (2.4±1 años) y viejos (9.1 ± 2.1 años), dando como resultado que el sexo, el peso corporal y la condición corporal no fueron significativamente diferentes entre los perros de los grupos. Sin embargo, la condición muscular fue significativamente más alto en los jóvenes, lo que indica una mayor pérdida de músculo en los perros viejos.4
Diagnóstico
I. Masa muscular disminuida: un porcentaje de masa muscular ≥2 desviaciones estándar debajo de la media medida en adultos jóvenes del mismo sexo y mismo grupo étnico.3
II. Prueba de baja velocidad: prueba de caminata que resulte en 0.8 m/s.3
CAQUEXIA
El término caquexia se deriva de las palabras griegas kakos (malo) y héxis (condición). Puede ser definido como un síndrome multifactorial caracterizado por pérdida severa de peso corporal, grasa y músculo e incluso afecta a proteínas cardíacas8 e incremento en el catabolismo muscular debido a enfermedades subyacentes.3
Se basa principalmente en el índice de masa corporal y no tiene en cuenta la composición corporal, es decir, masa libre de grasa y masa grasa3.
Es un síndrome metabólico complejo asociado con una enfermedad subyacente y caracterizado por la pérdida de músculo, con o sin pérdida de masa grasa, incluyen un considerable flujo de nitrógeno desde el músculo esquelético hacia el hígado.8 La caquexia se asocia frecuentemente con inflamación, resistencia a la insulina, anorexia y aumento de la degradación de las proteínas musculares.1 Una vez que se alcanza un punto crítico, la compleja interacción entre enfermedad subyacente, alteraciones metabólicas y disponibilidad reducida de nutrientes eventual e ineludiblemente causarán que el paciente muera.3
La anorexia parece ser más una consecuencia de la caquexia que una de sus causas, pues se puede desarrollar una vez que la pérdida de peso ya ha aparecido, pero lo que sí parece establecerse es un ciclo de realimentación positiva entre el debilitamiento progresivo y la falta de apetito, que se agravan así mutuamente.14
Mecanismos
– Aumento de los requerimientos de energía: en la insuficiencia cardíaca congestiva (ICC), se tienen mayores necesidades de energía en reposo como resultado de la activación simpática, aumento del trabajo respiratorio, y taquicardia.7
– Disminución de la absorción de nutrientes: debido a una disminución de la perfusión del tracto gastrointestinal, edema de la pared intestinal y aumento de colágeno; permitiendo la translocación de endotoxinas a través de la mucosa intestinal, lo que podría exacerbar la inflamación sistémica.7
– Disminución de la ingesta de energía: la anorexia se puede relacionar con estas enfermedades, ya que puede ser secundario a la fatiga, disnea o puede ser debido a la toxicidad de la medicación.7
Aunque incrementan los factores orexigénicos (el neuropéptido Y, la proteína r-agouti (AgRP) y la ghrelina), también aumentan muchos de los factores de saciedad ( ej., adiponectina, serotonina, insulina, proopiomelanocortina) o no disminuyen de manera apropiada ( ej., leptina).7
La ghrelina estimula la motilidad gástrica, tiene efectos antiinflamatorios, modula la secreción de la hormona del crecimiento en respuesta al ayuno, resultando en una mayor ingesta de alimento.7
Alteraciones en metabolismo: existe un flujo de proteínas alterado (es decir, síntesis de proteínas disminuida o catabolismo de proteínas aumentado) que resulta en una pérdida neta de tejido magro3,7,8.
Los factores que contribuyen a la pérdida de masa muscular incluyen inactividad física, aumento de la producción de citocinas, disminución de las concentraciones de hormonas (hormona del crecimiento, testosterona y factor de crecimiento insulínico -IGF-1).4 El IGF-1 media la mayoría de las acciones de la hormona del crecimiento. Los mediadores inflamatorios, como el TNF, alteran los efectos del IGF-1, lo que sugiere un papel importante en la patogenia de la caquexia.7
Las enfermedades crónicas y agudas alteran la regulación de citocinas inflamatorias, en especial interferón-Y (IFN-Y).8 TNF, interleucina-1b (IL-1) e interleucina-6 (IL-6), proteína C reactiva (CRP), catecolaminas, cortisol, insulina, glucagón, son factores primarios en la caquexia porque causan anorexia, aumentan el metabolismo energético y aceleran la pérdida de masa muscular magra7; durante el ayuno, las proteínas musculares son degradadas para proveer aminoácidos los cuales serán utilizados para la gluconeogénesis.8 Las alteraciones metabólicas secundarias a este síndrome, evitan que los pacientes caquécticos aumenten de peso, recuperen la masa corporal y les disminuye la sobrevida.14
Origen y estadificación
En un animal sano que no recibe suficientes calorías para cumplir con los requisitos, las adaptaciones metabólicas permiten que la grasa se utilice como fuente de combustible principal, preservando así la masa corporal magra. En los animales con enfermedades crónicas, la principal fuente de energía son los aminoácidos del músculo, de modo que estos animales catabolizan rápidamente los músculos y la masa corporal magra, provocando caquexia,7 mientras que otros órganos (hígado, bazo, riñón y adrenales) pueden llegar incluso a aumentar su peso transitoriamente.14
Los cambios que se producen no sólo son cuantitativos, sino que también son cualitativos en función muscular, ya que los músculos esqueléticos tienen una mayor cantidad de colágeno, una función mitocondrial alterada y un cambio de fibras tipo I (oxidativas) a tipo II b (glicolíticas), siendo estas últimas menos resistentes a la atrofia (L.M. Freeman, 2011). También, en caquexia avanzada se puede observar retención de agua en consecuencia de hipoalbuminemia severa, lo cual no se evidenciará en el peso corporal.3
– Caquexia cardiaca: la presencia de ésta confiere un mayor riesgo de muerte en las personas. En un estudio en perros se encontró que más del 50 % de los perros con cardiomiopatía dilatada e insuficiencia cardíaca congestiva tenían algún grado de caquexia.7
Existen efectos cardioprotectores de las adipocinas derivadas del tejido adiposo. Sin embargo, el beneficio de la obesidad en la ICC es probablemente debido más a la falta de caquexia, que a la obesidad per se, dados los efectos adversos asociados con la caquexia. Se ha observado que en pacientes con ICC que ganaron peso muscular tienen mayor supervivencia que los que se mantuvieron o bajaron, a esto se le conoce como obesidad paradójica.5,7
Suplementar con ácidos grasos omega-3 ayudará a disminuir las citocinas inflamatorias TNF e IL-1, también en enfermedades cardíacas tienen efectos antiarrítmicos y pueden mejorar el metabolismo energético del miocardio.5,7
Los inhibidores de la ECA pueden prevenir la caquexia cardíaca, debido a los efectos directos sobre el músculo, como una mejor capacidad oxidativa muscular y densidad capilar, así como una disminución de la inflamación.
La adiponectina se correlaciona con NT-pro BNP, la capacidad de ejercicio y la supervivencia.7
Caquexia por cáncer: un estudio en perros mostró que la condición corporal (CC) era baja en la minoría de los casos, el 35 % de estos tenía atrofia muscular severa. Un estudio en gatos con cáncer mostró pérdida de masa muscular en el 91 % de los gatos afectados.7
Se asocia a otros síntomas, en especial los gastrointestinales, como son: náuseas crónicas, xerostomía, pérdida de apetito y una saciedad temprana.12
– Caquexia renal: se ha probado obesidad paradójica así como en ICC; en pacientes con enfermedad renal crónica (ERC), hay una mayor supervivencia en quienes tienen obesidad o sobrepeso que en pacientes con un peso bajo o normal.7 En gatos que desarrollan enfermedad renal crónica (ERC), se puede observar pérdida de peso hasta tres años antes del diagnóstico.5
La pre-caquexia incluye a pacientes con una enfermedad crónica, una pequeña pérdida de peso, una respuesta inflamatoria sistémica crónica o recurrente y anorexia.3
La vía de señalización celular más importante implicada en los efectos del TNF y la IL-1 sobre la caquexia es la vía ubiquitina proteosoma, activada principalmente por la vía NF-KB que, a su vez, es estimulada por citocinas inflamatorias; la ubiquitina proteosoma puede inducir a caquexia a través de la vía miostatina. El TNF parece ser una de las señales para una mayor expresión de miostatina a través de NF-KB, pero otros factores, como la angiotensina II, también aumentan la expresión de miostatina, lo cual contribuye a la pérdida de masa muscular. Las catecolaminas y las neurohormonas ( ej., el sistema renina-angiotensina-aldosterona, epinefrina, cortisol) pueden aumentar el catabolismo. Los betabloqueantes disminuyen la oxidación de proteínas y la atrofia muscular en pacientes con ICC.7
Diagnóstico
Debe realizarse asociando la pérdida de masa magra con la presencia de una enfermedad primaria, y se deben realizar pruebas complementarias para el diagnóstico de las enfermedades con mayor probabilidad de causar caquexia, se consideran como métodos de diagnóstico: TC, DXA y el índice de masa corporal.13 Éste, aunque es relativamente de bajo costo, tiene resultados dudosos en cuanto a su precisión y fiabilidad, ya que no distingue entre tejido adiposo, musculatura y agua13.
CONCLUSIÓN
La sarcopenia es un síndrome geriátrico provocado en ausencia de enfermedad y difiere con la caquexia en que éste es un síndrome metabólico multifactorial que se asocia a una enfermedad subyacente (frecuentemente ERC, ICC, AR y/o cáncer) y que se acompaña con inflamación; ambas producen un deterioro del estado físico del paciente que puede llegar a una muerte temprana debido a las alteraciones metabólicas asociadas.
Ofrecer un diagnóstico temprano proporcionará mejores oportunidades de tratamiento y una mejora para la calidad de vida del paciente.
Referencias
- Cruz-Jentoft Alfonso J., et al. Sarcopenia: European consensus on definition and diagnosis. 2010. pp. 412- 423. Doi: 10.1093/ageing/afq034.
- J. Parker Valerie. Sarcopenia of ageing and cachexia in dogs and cats. Proceedings. 2018.
- M. Muscaritoli, et al. Consensus definition of sarcopenia, cachexia and precachexia: Joint document elaborated by Special Interest Groups (SIG) ‘‘cachexia-anorexia in chronic wasting diseases’’ and ‘‘nutrition in geriatrics’’. ELSEVIER. 2009. pp 154-159. Doi:10.1016/j.clnu.2009.12.004
- Hutchinson Dana, et al. Assessment of methods of evaluating sarcopenia in old dogs. American Journal of Veterinary Research. 2012. Vol 73, No. 11. Pag. 1794- 1800. ISSN: 2012;73:1794–1800
- J. Parker Valerie. Sarcopenia of ageing and cachexia in dogs and cats. Proceedings. 2018.
- Masanés T. Ferran, Navarro L. Marga, Sacanella M Emilio., et al.¿qué es la sarcopenia?. ELSEVIER. 2010. Vol. 11. pp. 14-23. DOI: 10.1016/j.semreu.2009.10.003
- L.M. Freeman. Cachexia and Sarcopenia: Emerging Syndromes of Importance in Dogs and Cats. American College of Veterinary Internal Medicine. 2011. pp 3-17. ISSN: 10.1111/j.1939-1676.2011.00838.x
- M. Argilés Josep, Busquets Silvia, López-Soriano Francisco J, et al. Fisiología de la sarcopenia. Similitudes y diferencias con la caquexia neoplásica. SciELO. 2006. vol.21. ISSN 0212-1611
- T.Lang, T. Streeper, P. Cawthon, et al. Sarcopenia: etiology, clinical consequences, intervention, and assessment. Osteoporosis international. 2010. Pag 543 – 559. DOI 10.1007/s00198-009-1059-y
- Nunes T. Vivian de Oliveira, Isabel F Lidiane., Machado X. Ricardo. Mecanismos de perda muscular da sarcopenia. SciELO. 2012. vol.52 no.2. ISSN 0482-5004
- Hernández S. Mirian, Mena C. Natalia. Sarcopenia en la población anciana institucionalizada. Tesis de Medicina. Universidad de Valladolid. España. 2017.
- J. M. Argilés, S. Busquets, F. J. López-Soriano, et al. Fisiopatología de la caquexia neoplásica. SciELO. 2006. Vol. 21. ISSN 1699-5198
- Oliveira T. Leonardo,Demier C. Leonardo, et al. Tópicos Especiais em Ciência Animal VII. CAUFES. 2018. ISBN: 978-85-54343-12-5.
- Pérez C. Dana A., Allende P. Silvia R., Meneses G. Abelardo, et al. Frecuencia de anorexia-caquexia y su asociación con síntomas gastrointestinales, en pacientes paliativos del Instituto Nacional de Cancerología, México. SciELO. 2014. ISSN 0212-1611.